
پایان انقراض انسان؛ آیا علم میتواند پیری را درمان کند و مرگ را به انتخابی اختیاری تبدیل کند؟
تولد ۱۵۰ سالگی در بدن یک فرد ۳۰ ساله
تصور کنید در سال ۲۱۰۰ میلادی زندگی میکنید. خانواده و دوستانتان برای صد و پنجاهمین سالگرد تولد شما دور هم جمع شدهاند. کیک تولد بزرگ است، اما شمعها نه بهعنوان نماد کهنسالی، بلکه صرفاً نشانه گذر زمان هستند. صورت شما هنوز شاداب است، پوستتان چروک عمیقی ندارد، عضلاتتان قدرت خود را حفظ کردهاند و ذهنتان مانند یک جوان ۳۰ ساله، سریع و خلاق عمل میکند.
شاید عجیب به نظر برسد، اما این تصویر دیگر صرفاً زاییده تخیل نویسندگان علمی–تخیلی نیست. امروزه درمان پیری به یکی از جدیترین و پرهزینهترین حوزههای تحقیقاتی در علم زیستشناسی و بیوتکنولوژی تبدیل شده است.
برای قرنها، انسان پیری و مرگ را بهعنوان سرنوشتی اجتنابناپذیر پذیرفته بود. اما اکنون دانشمندان این پرسش بنیادین را مطرح میکنند:
آیا مرگ یک قانون تغییرناپذیر فیزیکی است یا فقط یک مشکل فنی بیولوژیکی که میتوان آن را حل کرد؟
پاسخ به این سؤال، نهتنها طول عمر انسان، بلکه ساختار جامعه، اقتصاد، اخلاق و حتی معنای زندگی را دگرگون خواهد کرد.
چرا پیر میشویم؟ شناخت علمی دشمن اصلی
برای آنکه بتوان پیری را درمان کرد، ابتدا باید آن را بهدرستی فهمید. برخلاف تصور رایج، پیری یک فرآیند واحد و ساده نیست. علم مدرن پیری را مجموعهای از آسیبهای تدریجی در سطح سلولی و مولکولی میداند که بهمرور زمان انباشته شده و در نهایت عملکرد بدن را مختل میکنند.
کوتاه شدن تلومرها؛ شمارش معکوس عمر سلولها 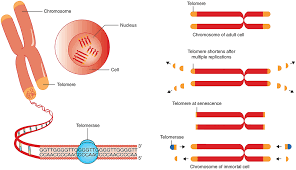
در انتهای هر کروموزوم، ساختارهایی به نام تلومر وجود دارند. این تلومرها مانند محافظی عمل میکنند که از DNA در برابر آسیبهای هنگام تقسیم سلولی محافظت میکند؛ درست شبیه پلاستیک انتهای بند کفش.
هر بار که یک سلول تقسیم میشود، تلومرها کمی کوتاهتر میشوند و توانایی تقسیم سلول کاهش مییابد. در نهایت سلول وارد مرحله پیری یا مرگ برنامهریزیشده میشود. آنزیمی به نام تلومراز میتواند تلومرها را ترمیم و بلندتر کند. این آنزیم در سلولهای بنیادی و سلولهای سرطانی فعال است، اما در اغلب سلولهای بدن بزرگسال خاموش میشود.
نکته علمی مهم:
جایزه نوبل پزشکی سال ۲۰۰۹ به الیزابت بلکبورن، کارول گریدر و جک ژوستاک برای کشف نقش تلومرها و تلومراز اهدا شد.
سلولهای زامبی؛ وقتی سلولها نمیمیرند اما آسیب میزنند
برخی سلولها در اثر استرس، آسیب DNA یا کوتاه شدن تلومرها وارد حالتی به نام سنسنت (Senescent) یا پیرشده میشوند. این سلولها ویژگی عجیبی دارند. دیگر تقسیم نمیشوند اما از بین هم نمیروند و مواد التهابی و سمی ترشح میکنند. به همین دلیل به آنها لقب سلولهای زامبی داده شده است. تجمع این سلولها با بیماریهایی مانند؛ آرتروز، دیابت نوع ۲، آب مروارید و تصلب شرایین ارتباط مستقیم دارد.
اختلال در میتوکندری؛ فرسودگی نیروگاههای سلولی
میتوکندریها مسئول تولید انرژی در سلول هستند. با افزایش سن؛ کارایی میتوکندری کاهش مییابد و تولید رادیکالهای آزاد افزایش پیدا میکند و آسیب به DNA، پروتئینها و غشای سلولی تشدید میشود. این چرخه معیوب یکی از موتورهای اصلی پیری در بدن انسان است.
قهرمانان نامیرای طبیعت؛ وقتی پیری یک قانون نیست
اگر پیری اجتنابناپذیر بود، طبیعت هرگز موجوداتی با طول عمرهای خارقالعاده خلق نمیکرد. اما شواهد زیستی خلاف این را نشان میدهد.
عروس دریایی نامیرا؛ بازگشت از مرگ به تولد
Turritopsis dohrnii تنها موجود شناختهشدهای است که چرخه زندگی خود را به عقب بازمیگرداند. وقتی این عروس دریایی آسیب میبیند، گرسنه میشود یا در معرض استرس قرار میگیرد؛ میتواند از مرحله بلوغ به مرحله نوزادی بازگردد و دوباره رشد کند. این فرآیند میتواند بینهایت بار تکرار شود.
موش کور برهنه؛ طول عمر بالا بدون سرطان 
این جانور کوچک و عجیب تا ۳۰ سال عمر میکند و تقریباً هرگز به سرطان مبتلا نمیشود. در مقایسه با موشهای معمولی که تنها ۲ تا ۳ سال عمر میکنند، این جانور سیستم ترمیم DNA بسیار پیشرفتهای دارد. این تفاوت، موش کور برهنه را به یکی از مهمترین مدلهای مطالعه پیری تبدیل کرده است.
نبرد علم با پیری؛ پیشرفتهترین فناوریهای ضدپیری
ویرایش ژنتیکی با CRISPR؛ بازنویسی برنامه عمر
فناوری CRISPR-Cas۹ امکان ویرایش دقیق DNA را فراهم کرده است. دانشمندان در حال بررسی فعالسازی ژنهای محافظ تلومر، خاموشسازی ژنهای مرتبط با سلولهای سنسنت و افزایش مقاومت سلولها در برابر استرس هستند.
داروهای سنولیتیک؛ حذف سلولهای پیرشده
داروهای سنولیتیک سلولهای زامبی را بهصورت هدفمند از بین میبرند. در آزمایشهای حیوانی این دارو موجب افزایش طول عمر، بهبود عملکرد قلب، مغز و عضلات و کاهش التهاب مزمن شده است. داروهایی مانند داساتینیب و کوئرستین امیدبخشترین نمونهها هستند.
جوانسازی خون؛ راز جوانی در رگها؟
آزمایشهای پارابیوسیس (اتصال خون موش جوان و پیر) نشان داد که مغز موش پیر جوانتر عمل میکند و عضلات و کبد بازسازی میشوند. شرکتهایی مانند Alcor Life Extension به بررسی پلاسما درمانی پرداختهاند، هرچند این حوزه از نظر اخلاقی و علمی بسیار بحثبرانگیز است.
سیلیکونولی و تجارت جاودانگی
Altos Labs؛ پروژه میلیاردی علیه پیری
شرکت Altos Labs با حمایت مالی افرادی مانند جف بزوس تأسیس شد و هدف آن برنامهریزی مجدد سلولها برای جوانسازی است.
این شرکت از دانشمندانی در سطح برندگان نوبل استفاده میکند.
نورالینک و جاودانگی دیجیتال 
ایلان ماسک با پروژه نورالینک به دنبال اتصال مغز انسان به رایانه است. هدف نهایی این پروژه ذخیره یا انتقال آگاهی و ایجاد نوعی جاودانگی دیجیتال است.
آیا جاودانگی فقط برای ثروتمندان است؟
یکی از بزرگترین نگرانیها در این رابطه دسترسی نابرابر به فناوریهای ضدپیری و تشدید شکاف طبقاتی است که منجر به این مسئله گردد که مگر فقط به «سرنوشت فقرا» مبدل شود.
چالشهای فلسفی و اخلاقی جهانی بدون مرگ
انفجار جمعیت و بحران منابع
اگر نرخ مرگ کاهش یابد منابع چگونه مدیریت میشوند؟ آیا مهاجرت فضایی ضروری میشود؟
معنای زندگی بدون مرگ
بسیاری از فلاسفه معتقدند ارزش زندگی از فانی بودن آن میآید و مرگ به زندگی معنا و فوریت میدهد. آیا در جهانی بدون مرگ، انگیزهها از بین نمیروند؟
نتیجهگیری: آیا ما آخرین نسل فانی هستیم؟
اگر پیری یک بیماری باشد، درمان آن یعنی حذف بزرگترین عامل مرگ بشر. دانشمندانی مانند آبری دیگری از مفهومی به نام سرعت گریز از پیری (Longevity Escape Velocity) سخن میگویند؛ نقطهای که علم سریعتر از پیر شدن ما پیشرفت میکند. برخی جسورانه معتقدند؛ نخستین انسان هزارساله، شاید همین حالا زنده باشد.
پرسش پایانی برای شما
اگر مطمئن باشید ۲۰۰ سال با سلامت کامل زندگی میکنید:
آیا باز هم عجله دارید؟
یا برای قرنها، آرام و حسابشده برنامهریزی میکنید؟
پاسخ شما، شاید بهترین راه برای درک آیندهای باشد که با سرعتی شگفتانگیز بهسوی ما میآید.

